Witajcie!
Zgodnie z obietnicą, dzisiejszy post będzie dotyczył omówienia konkretnych przykładów reakcji chemicznych, a dokładnie ich stechiometrycznego uzgadniania.
Do dzieła! :)
Przykład nr 1. Zacznijmy od jednej z najprostszych reakcji chemicznych, najbardziej rozpowszechnionych w przyrodzie, czyli od syntezy wody.
Napiszmy reakcję powstawania wody z wodoru i tlenu (bez uzgadniania współczynników stechiometrycznych):
Z załączonej reakcji możemy stwierdzić, że cząsteczka wodoru reaguje z cząsteczką tlenu tworząc cząsteczkę wody. Jednak czy powyżej zapisana reakcja jest poprawna?
Oczywiście, że nie. Zgodnie z prawem zachowania masy, ilość substratów (czyli reagentów tych z lewej strony) musi równać się ilości powstałych produktów (czyli reagentów z prawej strony).
W powyższym przypadku mamy:
po lewej stronie: 2 atomy wodoru + 2 atomy tlenu
po prawej stronie: 2 atomy wodoru i jeden atom tlenu ( w jednej cząsteczce wody)
2 wodory (lewa strona) = 2 wodory (prawa strona)
2 atomy tlenu (lewa strona) > 1 atom tlenu (prawa strona)
W tym przypadku należy dokonać uzgodnienia stechiometrycznego, gdzie finalnie poprawiona reakcja powinna wyglądać następująco:
Teraz mamy następującą ilość poszczególnych atomów:
po lewej stronie: 4 atomy wodoru (2 cząsteczki x 2 atomy) + 2 atomy tlenu
po prawej stronie: 4 atomy wodoru (2 x 2 atomy) i 2 atomy tlenu
4 wodory = 4 wodory
2 atomy tlenu = 2 atomy tlenu
Pamiętaj! przy uzgadnianiu reakcji, nie możesz zmieniać wzoru związku chemicznego (tzn. dopisywać współczynników w indeksach dolnych, gdzie popadnie ;) np. tworząc nowe związki tj. H3O ). Natomiast możesz zwiększać/zmniejszać ilość cząsteczek (dopisywanie współczynników przed daną cząsteczką/związkiem chemicznym, tak jak zostało zrobione w powyższym przykładzie).
Przykład nr 2 Synteza NaCl (chlorku sodu), czyli powszechnie używanej soli kuchennej :)
Napiszmy najpierw reakcję chemiczną:
Powyższa reakcja oznacza, że jeden atom sodu reaguję z jedną cząsteczką (dwuatomową) chloru i powstaje jedna cząsteczka chlorku sodu - oczywiście reakcję trzeba uzgodnić ;)
Obecnie mamy:
po lewej stronie: jeden atom sodu + 2 atomy chloru
po prawej stronie: jeden atom sodu i jeden atom chloru w jednej cząsteczce chlorku sodu
1 atom sodu = 1 atom sodu w NaCl, ale
2 atomy chloru > 1 atomu chloru w NaCl
Nie zgadza się, więc uzgadniamy:
Jak to robimy?
Właśnie tak :)
Sprawdzamy, którego atomu nam brakuję i po której stronie. Skoro chloru w NaCl było za mało, to dopisujemy wielką DWÓJKĘ przed NaCl i sprawdzamy jeszcze raz ;). Po dopisaniu dwójki przed NaCl zwiększyliśmy nie tylko liczbę Cl, ale również Na, więc wracamy na początek reakcji i dopisujemy również duże DWA przed Na i teraz mamy:
po lewej stronie: 2 atomy Na + 2 atomy Cl
po prawej stronie: 2 atomy Na i 2 atomy Cl w NaCl
2 atomy sodu = 2 atomy sodu w NaCl oraz
2 atomy chloru = 2 atomy chloru w NaCl
Wszystko się teraz zgadza! :)
Przykład nr 3. Teraz reakcja odwrotna od reakcji syntezy (tj. powstawanie bardziej złożonych związków ze związków prostych), czyli reakcja analizy (tj. rozpad związków złożonych na związki proste).
W tym przypadku mamy analizę tlenku miedzi (II) na związki proste tj. miedź i tlen.
Cząsteczka CuO rozpada się na atom miedzi Cu oraz cząsteczkę tlenu.
po lewej stronie: jeden atom miedzi i jeden atom tlenu w jednej cząsteczce CuO
po prawej stronie: jeden atom miedzi + dwa atomy tlenu
Po uzgodnieniu stechiometrycznym:
po lewej stronie: 2 atomy miedzi i 2 atomy tlenu w jednej cząsteczce CuO
po prawej stronie: 2 atomy miedzi + 2 atomy tlenu
2 Cu (w CuO) = 2 Cu
2 O (w CuO) = 2 O
Proste, prawda?
Teraz zadanie dla Was :):
Dobierz współczynniki w następujących reakcjach:
Powodzenia! ;)
Jeżeli macie jakieś pytania odnośnie omówionego tematu, piszcie na adres: chemia.na.6stke@gmail.com
Zapraszam!
Miłego tygodnia! ;)

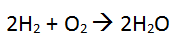


Brak komentarzy:
Prześlij komentarz